Клас:___________
П.І.:___________________________________
Контрольна
робота № 2
8 клас
І. Початковий рівень.
1. Вкажіть формулу солі, яку
використовують люди для приготування їжі:
а) NаCl; б) КCl; в) NаNО3; г) НCl.
2. Розчин основи змінює колір індикатора
лакмусу на:
а) синій; б) не змінює; в) рожевий;
г) безбарвний.
3. Встановіть відповідність між
формулами речовин та їх назвами:
а) Fe2О3; б) Fe2
(SО4)3; в) Fe( NО3)3; г)
Fe(ОН)2.
1) ферум (ІІІ) сульфат; 2) ферум (ІІІ) оксид; 3) ферум
(ІІІ) нітрат; 4) ферум (ІІ)гідроксид.
4. Формули оксиду, основи, солі
відповідно:
а) Fe2О3; Н2SО4;
КОН; б)К2О; Fe(ОН)2; СаСО3.
5. Вкажіть ряд речовин, в якому
наведено тільки оксиди :
а) K2SO3
; NaOH ; HCl ; б) NaCl ; CaSO4 ; BaI2
; в) CaO ; Na2O ; Al2O3
.
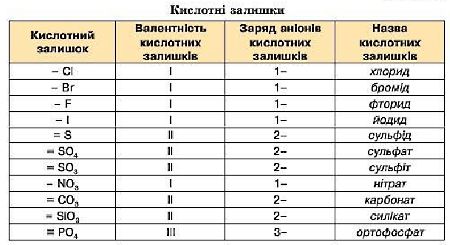
6. Напишіть формули кислот : сульфітна, фосфатна, хлоридна.
7. Позначте назву основи :
а) Калій хлорид ; б) Натрій гідроксид ; в) Алюміній сульфат ; г) Магній оксид.
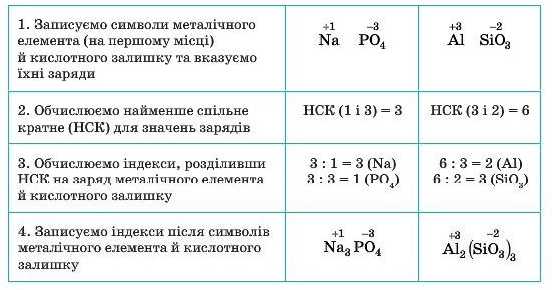
8. Складіть формули солей : Калій
хлориду, Магній карбонату, Цинк
нітрату.
ІІ. Середній рівень.
1. З перерахованих властивостей
вкажіть ті, які характерні для солей:
а) взаємодіє з водою; б) взаємодіє з металами; в) взаємодіє з
кислотами.
2. З натрій гідроксидом взаємодіють:
а) Nа2СО3; б)
Fe2 (SО4)3; в)FеCl3; г) FeSіО3.
3. Закінчіть рівняння реакції : СuО +
Н2SО4 →. Це реакція:
а) сполучення; б)розкладу; в)обміну; г) заміщення.
ІІІ. Достатній рівень.
1.Запишіть рівняння реакції і укажіть загальну суму коефіцієнтів в
рівнянні реакції взаємодії фосфор (V) оксиду з водою :
а) 7 б) 5 в) 6
г) 4
2. Зробіть необхідні обчислення і укажіть кількість речовини азоту N2 масою 56 г :
а) 1 б) 1,5 в) 2
г) 3
3. Завершити рівняння:
а)KOH + Zn (OH)2
→ б) SO3 + Mg(OH)2 в) Al2O3 + H2SO4
4. Здійсніть перетворення:
Mg → MgO → Mg(OH)2 → Mg3(PO4)2.
ІV. Високий рівень.
Обчисліть, коли утвориться більше водню: у результаті взаємодії сульфатної кислоти з магнієм масою 10 г чи з цинком масою 10 г.
§42, 43 Генетичні зв’язки між простими речовинами й основними класами неорганічних сполук
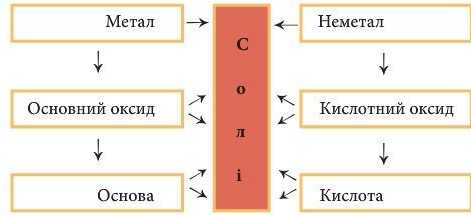

§41 Хімічні властивості солей

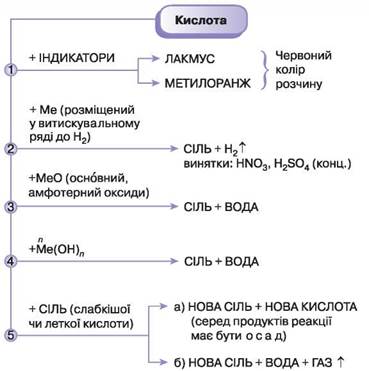
§40 Хімічні властивості кислот







| а) K2O + H2O →2 КОН | б) CaO + H2O →Ca(OH)2 | в) Na2O + H2 → 2Na+H2O |
| г) CuO + H2 → Сu+H2O | д) BaO + 2HCl → BaCl2+H2O | е) Na2O + H2S →Na2 S+ H2O |
| а) Al2O3 +3SO3 →Al2(SO4)3 | б) MgO + CO2 → MgCO3 | в) SO2 + H2O →H2 SO3 |
| г) P2O5 +3H2O →2H3PO4 | д) CO2 + 2KOH → K2CO3+ H2O | е) SO3 + 2KOH → K2SO4+H2O |
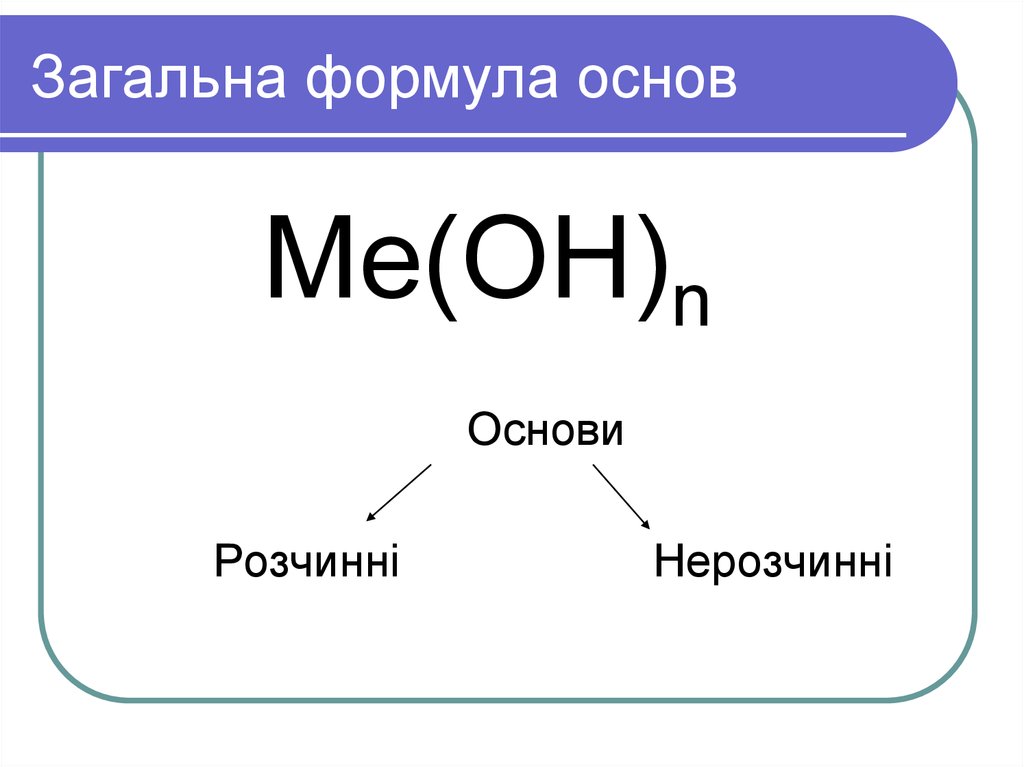
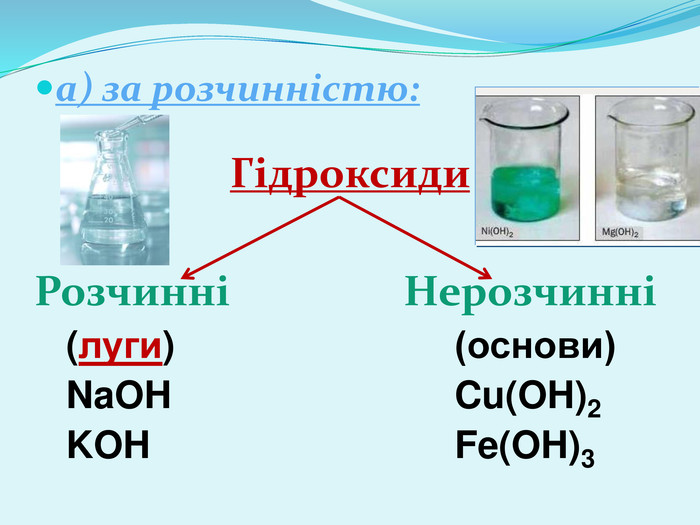
§38 Хімічні властивості основ
1. Зробити записи в зошиті:

2. Запишить схему у зошит:

- Дія лугу на індикатори:
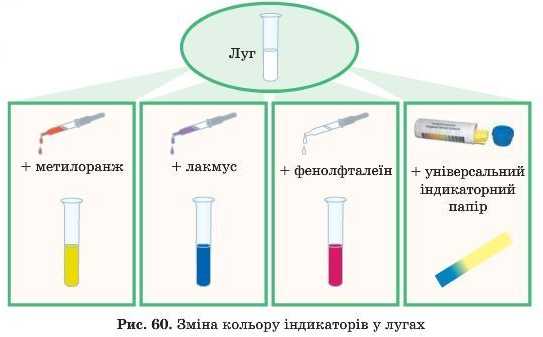

3.

§39 Амфотерні оксиди та основи
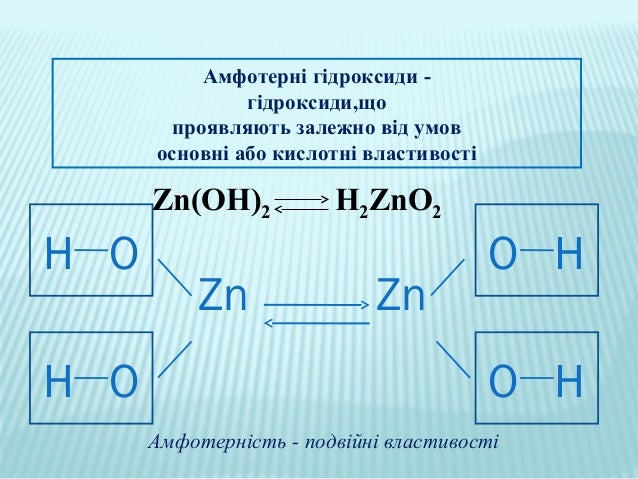


2. Зробити записи у зошиті (користуючись інформацією блога або підручником) .
3. Виконати завдання:№136, 138 (а, г, д),
4. Тестові завдання №143-145
37. Розрахунки за хімічними рівняннями
1. Запишить алгоритм розв'язання задач:Для складання пропорцій беремо такі відношення: m/m; V/V; υ/υ, якщо: m (г), то V (л); m (кг), то V (м3); m (мг), то V (мл).
УВАГА!!!!
(Словесне пояснення до розв'язання задачі писати не потрібно!!!!!)
Записуєте тільки ДАНО та Розв'язання!!!
38.1. Визначення маси однієї речовини за відомою масою іншої речовини
1. Записуємо скорочену умову задачі.
2. Пишемо рівняння реакції.
3. Розставляємо коефіцієнти у рівнянні.
4. Підкреслюємо формули речовин, які нас цікавлять за умовою задачі.
5. Над формулами цих речовин записуємо дані з умови задачі.
6. Під формулами цих речовин зазначаємо кількість речовини (рівна коефіцієнту), молярну масу і масу.
7. Масу їх розраховуємо за формулою: m = υ • M.
8. Складаємо пропорцію і розв’язуємо її.
9. Записуємо відповідь.
|
Дано:
m(Fe) = 5,6 г
|
Розв’язання:
|
m(HCl) – ?
| ||
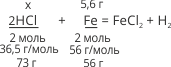
x/73 = 5,6/56; x = 73•5,6/56 = 73•1/10 = 7,3 г.
Відповідь: щоб розчинити залізо, маса якого 5,6 г, необхідно 7,3 г HCl.
| ||
38.2. Визначення об’єму однієї речовини за відомою масою іншої
1. Записуємо скорочену умову задачі.
2. Записуємо рівняння реакції. Підкреслюємо формули речовин, які нас цікавлять за умовою задачі. Над формулами цих речовин записуємо дані з умови задачі.
3. Під формулами цих речовин записуємо кількість речовини (коефіцієнт).
За молярним об’ємом визначимо об’єм водню, а за молярною масою – масу води.
4. Складаємо пропорцію і розв’язуємо її.
5. Записуємо відповідь.
|
Дано:
m(H2O) = 3,6 г
|
Розв’язання:
|
V(H2) – ?
| ||
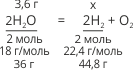
3,6/36 = x/44,8; x = 3,6•44,8/36 = 4,48 (л).
Відповідь: під час електролізу води масою 3,6 г виділиться 4,48 л водню.
| ||
38.3. Обчислення кількості речовини одного реагента за відомою кількістю речовини іншого реагента або продукту реакції
1. Записуємо скорочену умову задачі.
2. Записуємо рівняння реакції. Підкреслюємо формули речовин, які нас цікавлять за умовою задачі. Над формулами цих речовин записуємо дані з умови задачі.
3. Якщо за умовою задачі нас цікавлять лише кількості речовин, то для розрахунків беремо коефіцієнти. Під формулами цих речовин записуємо кількість речовини, яка відповідає їх коефіцієнтам.
4. Складаємо пропорцію і розв’язуємо її.
5. Записуємо відповідь.
|
Дано:
υ(O2) = 5 моль
|
Розв’язання:
|
υ(C) – ?
| ||
x/1 = 5/1; x = = 5 (моль).
Відповідь: У кисні кількістю речовини 5 моль можна спалити вуглець кількістю речовини 5 моль.
| ||
38.4. Обчислення об’єму одного реагента за відомою кількістю речовини іншого реагента
1. Записуємо скорочену умову задачі.
2. Складаємо рівняння реакції. Підкреслюємо формули речовин, які нас цікавлять за умовою задачі. Над формулами цих речовин записуємо дані з умови задачі.
3. Під формулою заліза записуємо кількість речовини, а під формулою кисню – кількість речовини, молярний об’єм і об’єм.
4. Складаємо пропорцію і розв’язуємо її.
5. Записуємо відповідь.
|
Дано:
υ(Fe) = 0,2 моль
|
Розв’язання:
|
V (O2) – ?
| ||
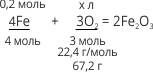
0,2/4 = х/67,2; x =67,2•0,2/4 = 3,36 (л).
Відповідь: V(O2) = 3,36 л.
| ||
38. 5. Обчислення маси одного реагента за відомою кількістю речовини іншого реагента або продукту реакції
1. Записуємо скорочену умову задачі.
2. Записуємо рівняння реакції. Підкреслюємо формули речовин, які нас цікавлять за умовою задачі. Над формулами цих речовин записуємо дані з умови задачі.
3. Якщо за умовою задачі нас цікавлять кількості речовин, то для розрахунків беремо коефіцієнти. Під формулами цих речовин записуємо кількість речовини, яка відповідає їх коефіцієнтам.
4. Складаємо пропорцію і розв’язуємо її.
5. Записуємо відповідь.
|
Дано:
υ(O2) = 5 моль
|
Розв’язання:
|
υ(C) – ?
| ||
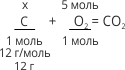
x/12 = 5/1; x=12•5/1 = 60 г.
Відповідь: У кисні кількістю речовини 5 моль можна спалити вуглець масою 60 г.
| ||
Хімічні властивості оксидів (параграф 36)
3. Домашнє завдання.
| а) K2O + H2O → … | б) CaO + H2O → … | в) Na2O + H2 → … |
| г) CuO + H2 → … | д) BaO + HCl → … | е) Na2O + H2S → … |
| а) Al2O3 + SO3 → … | б) MgO + CO2 → … | в) SO2 + H2O → … |
| г) P2O5 + H2O → … | д) CO2 + KOH → … | е) SO3 + KOH → … |
Взаємодія води з оксидами
Відповіді надсилати на ел. chemistry.nvk26@gmail.com




металів
з кислотами§33
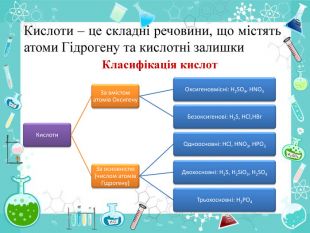
«Кислоти, їх склад, назви, класифікація.









Немає коментарів:
Дописати коментар